腸内常在細菌叢を用いた薬剤耐性菌・炎症性腸疾患の新規治療-腸内環境の制御による腸内細菌科細菌の抑制-
慶應義塾大学医学部微生物学・免疫学教室の本田賢也教授を中心とする共同研究グループは、健常者の腸内常在細菌の中から、腸管内でクレブシエラや大腸菌の抑制に重要な働きをしている18種類の菌を同定しました。この18種類の菌を混ぜ合わせて一緒に投与することで、腸管内のクレブシエラや大腸菌を1/1000以下に減少させる効果があることがマウス実験で確認されました。さらに、これらの18種類の菌はクレブシエラの主要なエネルギー源であるグルコン酸をより多く消費し、その結果としてクレブシエラの増殖を抑制していることを突き止めました(図1)。
今回の成果は、現在世界中で問題となっているクレブシエラや大腸菌による薬剤耐性菌対策や、クレブシエラや大腸菌によって悪化した炎症性腸疾患の治療としても期待されます。
本研究結果は、2024年9月19日に国際学術雑誌Natureオンライン版に掲載されました。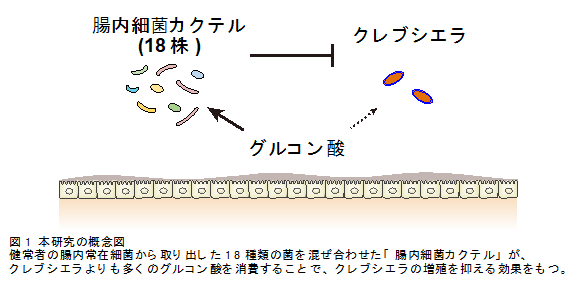
1.研究の背景と概要
近年、抗菌薬が効かない多剤耐性菌(注1)による感染症が、世界中で大きな問題となっています。特に多剤耐性菌の重症感染症を引き起こすことが知られている「クレブシエラ」や「大腸菌」などの菌は、腸内に住み着いて増えることが、感染症発症のリスクとなります。また、これらの菌は炎症性腸疾患(注2)を悪化させることも知られています。
一方で、腸内には、病原菌や耐性菌を抑える「良い菌」も存在します。最近の研究では、便移植(注3)という方法を使って、これらの良い菌を腸に移すことで、クレブシエラや大腸菌を減らすことができると報告されています。しかし、便移植は使用する便によって効果が異なり、安全性の問題もあるため、まだ広く使われる治療法にはなっていません。
そこで、健康な人の腸内からクレブシエラや大腸菌を排除できる菌を探索しました。クレブシエラや大腸菌の耐性菌を保菌している人や、症状が悪化している炎症性腸疾患患者に対して、これらの菌を「腸内細菌カクテル」として混ぜ合わせて投与することで、より効果的で安全な治療法の実現を目指して研究を行いました。
2.研究の成果と意義・今後の展開
まず、菌が全くいない無菌マウス(注4)に口からクレブシエラを投与し腸内に定着させました。その後、健常者の便を投与すると、便中のクレブシエラの菌量は大幅に減少しました(図2)。さらに、投与した健常者の便のひとつから31種類の菌を取り出し、その中で特にクレブシエラを腸内から減少させる働きがある18種類の菌を特定しました(図2)。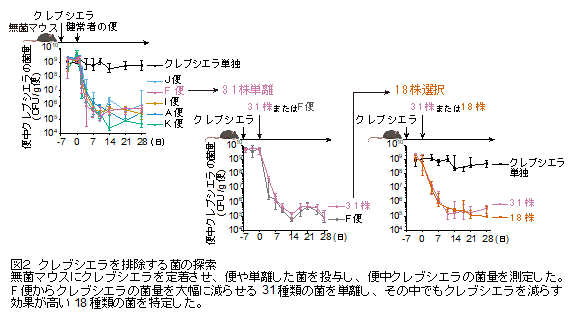
この18種類の菌は、抗菌薬に耐性をもつクレブシエラや大腸菌、さらに炎症性腸疾患患者で炎症を引き起こすような複数の株に対しても、マウスの腸内で減少させる効果が確認されました。
さらに、炎症性腸疾患のモデルとして使われるIl10-/-マウス(注5)に大腸菌を多く含む炎症性腸疾患患者の便を投与すると、腸内に重度の炎症が起こりました。しかし、この18種類の菌を投与すると、大腸菌が排除され、腸の炎症も軽度になりました(図3)。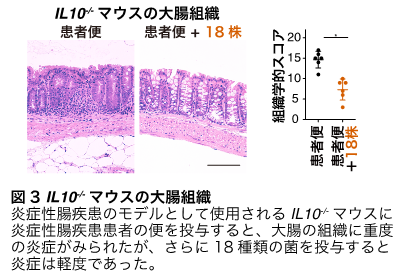
また、クレブシエラがマウスの腸管内でよく増えるような環境では、gntRという遺伝子に変異がある株が特によく増えやすいことがわかりました。このgntRという遺伝子は、クレブシエラにとって重要なエネルギー源の一つであるグルコン酸の取り込みや代謝を抑える役割を持っています。しかし、このgntRに変異がある株では、グルコン酸を効率的に利用できるため、他の株よりも早く増殖することが可能になります。実際に、クレブシエラがよく増える環境では、マウスの便中にグルコン酸が多く含まれていることも確認されました。
一方で、18種類の菌が存在すると、gntRに変異がある株が逆に減少し、便中のグルコン酸の量も少ないことがわかりました。このことから、18種類の菌がグルコン酸をより多く消費することで、クレブシエラに必要なエネルギー源が減り、その結果クレブシエラの増殖が抑えられていることが明らかになりました(図1)。
今回の研究の結果から、18種類の菌を混ぜ合わせた「腸内細菌カクテル」をクレブシエラや大腸菌の耐性菌を保菌している人に用いることで、耐性菌による感染症発症予防となる可能性が示されました。さらに炎症性腸疾患患者に使用することで、クレブシエラや大腸菌により悪化した症状の改善も見込まれます。この治療法は、抗菌薬に頼らず、効果的で安全な新しい治療戦略として期待できます。
3.特記事項
今回の研究の一部は、国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業腸内細菌株カクテルを用いた新規医薬品の創出、次世代治療・診断実現のための創薬基盤技術開発事業腸内マイクロバイオーム制御による次世代創薬技術の開発/課題2:有益細菌探索に基づく合理的に設計された新規MB制御医薬品の創出、ムーンショット型研究開発事業健康寿命伸長にむけた腸内細菌動作原理の理解とその応用、JSPS科研費JP20H05627、World Premier International Research Center Initiative (WPI), MEXT, Japan 「ヒト生物学-微生物叢-量子計算研究センター (WPI-Bio2Q)」における研究開発の一環として行われました。
4.論文
英文タイトル:Commensal consortia decolonize Enterobacteriaceae via ecological control
タイトル和訳:腸内常在細菌を用いた生態学的制御による腸内細菌科細菌の排除
著者名:古市宗弘、河口貴昭、Marie-Madlen Pust、安間-水戸部恵子、Damian R. Plichta、
長谷川有美、大宅喬、Shakti Bhattarai、笹島悟史、青戸良賢、Timur Tuganbaev、
八木沼瑞紀、上田政宏、岡橋伸幸、天藤公子、切通優子、杉田香代子、Martin Stražar、
Julian Avila-Pacheco、Kerry Pierce、Clary B. Clish、Ashwin N. Skelly、服部正
平、中本伸宏、Silvia Caballero、Jason M. Norman、Bernat Olle、田之上大、須
田亙、有田誠、Vanni Bucci、新幸二、Ramnik J. Xavier、本田賢也
掲載誌:Nature
DOI:doi.org/10.1038/s41586-024-07960-6
5.共同研究グループ
慶應義塾大学医学部微生物学・免疫学教室(古市宗弘、河口貴昭、安間-水戸部恵子、長谷川有美、大宅喬、笹島悟史、Timur Tuganbaev、八木沼瑞紀、杉田香代子、Ashwin N. Skelly、田之上大、新幸二、本田賢也)
理化学研究所生命医科学研究センター(古市宗弘、河口貴昭、大宅喬、上田政宏、岡橋伸幸、服部正平、田之上大、須田亙、有田誠、新幸二、本田賢也)
米国Broad Institute of MIT and Harvard(Marie-Madlen Pust、Damian R. Plichta、Martin Stražar、Julian Avila-Pacheco、Kerry Pierce、Clary B. Clish、Ramnik J. Xavier)
JSR・慶應義塾大学医学化学イノベーションセンター(古市宗弘、河口貴昭、安間-水戸部恵子、長谷川有美、大宅喬、笹島悟史、青戸良賢、八木沼瑞紀、上田政宏、天藤公子、切通優子、杉田香代子、Ashwin N. Skelly、田之上大、新幸二、本田賢也)
慶應義塾大学医学部内科学教室(中本伸宏)
Vedanta Biosciences(Silvia Caballero、Jason M. Norman、Bernat Olle)
慶應義塾大学 ヒト生物学-微生物叢-量子計算研究センター (WPI-Bio2Q)(Timur Tuganbaev、有田誠、新幸二、本田賢也)
【用語解説】
- (注1) 多剤耐性菌:多くの抗菌薬に対して耐性を持つ細菌。これらの菌による感染症を発症した際に通常の治療では効果がなく、治療が難しくなります。現在世界中で問題となっており、特にカルバペネムという広域抗菌薬に耐性をもつ腸内細菌科細菌は2019年にはCDCから切迫した脅威として取り上げられています。
- (注2)炎症性腸疾患:クローン病や潰瘍性大腸炎など、慢性的な腸の炎症が起こる疾患。原因は完全に解明されていませんが、遺伝的要因と環境要因が関与していると考えられています。環境要因の一つとして、炎症性腸疾患の患者から分離されたクレブシエラが腸の炎症を惹起していることが確認されています。
- (注3)便移植:健康な人の便を病気の患者さんの腸管内に投与し、腸内細菌叢を整えることで疾患の改善を期待する治療法です。再発性クロストリディオイデス・ディフィシル感染症や難治性炎症性腸疾患などのほか、さまざまな疾患で研究が行われています。まだ研究段階であり、投与方法や投与量など確立されていません。
- (注4)無菌マウス:無菌状態で飼育できる特殊な飼育装置(アイソレーター)内で滅菌した餌のもと飼育した、腸内細菌や皮膚などの常在菌を含め、細菌や微生物をまったく持たないマウス。常在菌をもたないため、生理学的、免疫学的にいくつかの異常がみられますが、健康な状態を維持しています。
- (注5)Il10-/-マウス:インターロイキン-10(IL-10)という遺伝子を欠損させたマウス。IL-10は、免疫反応を抑制する役割を持つサイトカインであり、炎症反応を抑える働きをします。腸内細菌の刺激により慢性腸炎を自然発症するため、炎症性腸疾患のモデルマウスとして研究に使用されています。
※ご取材の際には、事前に下記までご一報くださいますようお願い申し上げます。
※本リリースは文部科学記者会、科学記者会、厚生労働記者会、厚生日比谷クラブ、各社科学部等に送信しております。
【本発表資料のお問い合わせ先】
慶應義塾大学医学部 微生物学免疫学教室
教授 本田 賢也(ほんだ けんや)
TEL:03-5363-3769 FAX:03-5361-7658 E-mail:kenya@keio.jp
https://www.microbiolimmunol.med.keio.ac.jp/
慶應義塾大学医学部 小児科学教室
助教 古市 宗弘(ふるいち むねひろ)
TEL:03-5363-3816 FAX:03-5379-1978 E-mail:furuichi-mm@keio.jp
http://pedia.med.keio.ac.jp/wp/
【本リリースの配信元】
慶應義塾大学信濃町キャンパス総務課:飯塚・岸
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612 E-mail:med-koho@adst.keio.ac.jp
理化学研究所 広報室 報道担当
Tel: 050-3495-0247
Email: ex-press [at] ml.riken.jp
JSR株式会社 広報部:北村・王
〒105-8640 東京都港区東新橋一丁目9番2号 汐留住友ビル 22F.
TEL:03-6218-3517 Email: jsr_koho@jsr.co.jp
